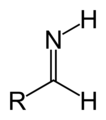
Imina atau imino adalah gugus fungsi atau senyawa kimia yang mengandung ikatan rangkap karbon–nitrogen. Atom nitrogen dapat melekat pada hidrogen (H) atau gugus organik (R). Jika gugus ini bukan atom hidrogen, maka senyawa tersebut kadang-kadang dapat dirujuk sebagai basa Schiff Atom larbon atom memiliki tambahan dua ikatan tunggal
Imina ( / ɪ ˈ m ː n / atau / ˈ ɪ m ɪ n / ) adalah gugus fungsi atau senyawa kimia yang mengandung ikatan rangkap karbon - nitrogen . Atom nitrogen dapat dilekatkan ke hidrogen (H) atau grup organik (R). Jika kelompok ini bukan atom hidrogen, maka senyawa tersebut kadang-kadang dapat disebut sebagai pangkalan Schiff . Atom karbon memiliki dua ikatan tunggal tambahan. Istilah "imine" diciptakan pada tahun 1883 oleh kimiawan Jerman Albert Ladenburg .
Nomenklatur dan klasifikasi
Biasanya imina mengacu pada senyawa dengan konektivitas R 2 C = NR, seperti yang dibahas di bawah ini. Dalam literatur yang lebih tua, imina mengacu pada analog aza dari epoksida. Dengan demikian, etilenimin adalah spesies cincin beranggota tiga C2H4 NH.
Imina terkait dengan keton dan aldehid dengan penggantian oksigen dengan kelompok NR. Ketika R = H, senyawa tersebut adalah imina primer, ketika R adalah hidrokarbil , senyawa tersebut adalah imina sekunder. Imina menunjukkan reaktivitas yang beragam dan biasanya ditemui di seluruh kimia. Ketika R 3 adalah OH, imine disebut oksime , dan ketika R 3 adalah NH 2 imina disebut hidrazon .
Imina primer di mana C melekat pada hidrokarbil dan H disebut aldimine primer ; imina sekunder dengan kelompok seperti ini disebut aldimine sekunder . Imina primer di mana C melekat pada dua hidrokarbil disebut ketimine primer ; imina sekunder dengan kelompok seperti ini disebut ketimin sekunder .
Reaksi yang paling penting dari imina adalah hidrolisis mereka ke senyawa amina dan karbonil yang sesuai. Jika tidak, gugus fungsi ini berpartisipasi dalam banyak reaksi lain, banyak yang analog dengan reaksi aldehida dan keton.
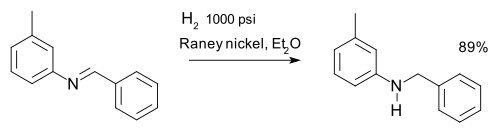
Imina dapat direduksi menjadi amina melalui hidrogenasi misalnya dalam sintesis m -tolylbenzylamine: [
Zat pereduksi lain adalah lithium aluminium hidrida dan natrium borohidrida . [17] Asymmetric imine reduction pertama dilaporkan pada tahun 1973 oleh Kagan menggunakan Ph (Me) C = NBn dan PhSiH 2 dalam hidrosililasi dengan ligan kiral Katalis DIOP dan rhodium (RhCl (CH 2 CH 2 ) 2 ) 2 . [18] Banyak sistem telah diselidiki.
- Aldimine primer
- Aziridine dan turunannya kadang-kadang disebut sebagai imina.
- RNH 2 + R′C (O) R ′ ′ → RN = C (R ′) (R ′ ′) + H 2 O
- Reaksi dari azida organik dengan logam carbenoid (diproduksi dari senyawa diazocarbonyl).
- Kondensasi asam karbon dengan senyawa nitroso .
- Penataan ulang trityl N-haloamines dalam penataan ulang Stieglitz .
- Dehidrasi hemiaminal .
- Dengan reaksi alkena dengan asam hidrazoat dalam reaksi Schmidt .
- Dengan reaksi asam nitril, asam klorida, dan aren dalam reaksi Hoesch .
- Sintesis multikomponen 3- tiazolina dalam reaksi Asinger .
- Ketimin primer dapat disintesis melalui reaksi Grignard dengan nitril .
Hexafluoroacetone imine adalah ketimine primer yang tidak biasa yang stabil.
- Imina berkurang dalam aminasi reduktif .
- Imina bereaksi dengan amina ke aminal , lihat misalnya sintesis cucurbituril .
- Sebuah imina bereaksi dengan diena dalam reaksi Aza Diels-Alder ke tetrahidropiridin.
- Imina dapat dioksidasi dengan asam meta-kloroperoksibenzoat (mCPBA) untuk memberikan oksaziridin
- Sebuah imina aromatik bereaksi dengan enol eter ke quinoline dalam reaksi Povarov .
- A tosylimine bereaksi dengan senyawa karbonil α, β-unsaturated ke amina alilik pada reaksi Aza-Baylis-Hillman .
- Imina adalah perantara dalam alkilasi amina dengan asam format dalam reaksi Eschweiler-Clarke .
- Penataan ulang dalam kimia karbohidrat yang melibatkan imina adalah penataan ulang Amadori .
- Reaksi transfer metilena dari imina oleh sulfonium ylide tidak stabil dapat memberikan sistem aziridine .
- Imina bereaksi, secara termal, dengan ketena dalam sikdisi siklik [2 + 2] untuk membentuk β-laktam dalam sintesis Staudinger .
- Sebuah imina dapat bereaksi dengan dialkilfosfit dalam reaksi Pudovik dan reaksi Kabachnik-Fields
Imina dapat direduksi menjadi amina melalui hidrogenasi misalnya dalam sintesis m -tolylbenzylamine: [
Zat pereduksi lain adalah lithium aluminium hidrida dan natrium borohidrida . [17] Asymmetric imine reduction pertama dilaporkan pada tahun 1973 oleh Kagan menggunakan Ph (Me) C = NBn dan PhSiH 2 dalam hidrosililasi dengan ligan kiral Katalis DIOP dan rhodium (RhCl (CH 2 CH 2 ) 2 ) 2 . [18] Banyak sistem telah diselidiki.
Amina adalah senyawa organik
dan gugus fungsi yang mengandung nitrogen basa dengan pasangan elektron
bebas. Perlindungan nitrogen terus menarik banyak perhatian dalam
bidang kimia, seperti peptida, nukleosida, polimer dan sintesis ligan.
Tetapi, dalam beberapa tahun terakhir, sejumlah gugus pelindung nitrogen
telah digunakan sebagai pembantu kiral. Dengan demikian, desain baru,
lebih ringan dan metodenya lebih efektif untuk perlindungan nitrogen
masih aktif dalam topik sintesis kimia.
Gugus
Pelindung imida dan amida: Kelompok ftalimida telah berhasil digunakan
untuk melindungi gugus amino. Pembelahan dari N-alkilftalimida (1,81)
mudah dilakukan dengan hidrazin, dalam larutan panas atau dalam dingin
untuk waktu yang lama untuk memberikan (1,82) dan amina. Basa katalis
hidrolisis N-alkilftalimida (1.81) juga memberikan yang sesuai amina.
Modifikasi Kitosan
Adanya gugus amina (NH2) dan dan hidroksil (OH) dari kitosan menyebabkan kitosan mudah dimodifikasi secara kimia.
Gugus aktif pada kitosan
Bila
dibutuhkan perubahan gugus fungsional untuk menghalangi gangguan dalam
beberapa rangkaian reaksi sintesis, salah satu caranya adalah dengan
menggunakan gugus pelindung. Gugus pelindung merupakan suatu turunan
yang dapat dibuat dan kemudian dihilangkan. Tiga syarat-syarat yang
perlu diperhatikan dalam memilih gugus pelindung adalah sebagai berikut :
1. Gugus pelindung yang digunakan harus lebih reaktif
2. Gugus pelindung yang dipakai harus dengan mudah bereaksi dengan molekul target.
3. Kondisi reaksi dalam memasukkan gugus pelindung harus stabil.
4. Dapat dimasukkan pada kondisi reaksi lunak
5. Gugus pelindung harus dapat dengan mudah dihilangkan tanpa menggangu reaksi akhir.
Reaksi
penggunaan gugus pelindung pada kitosan dikarenakan kitosan memiliki 2
gugus fungsi yang kereaktifan berbeda. Gugus amino dari kitosan lebih
reaktif dari pada gugus hidroksilnya, sehingga untuk menghasilkan
O-asilasi kitosan, perlu dilakukan proteksi atau perlindungan terhadap
gugus amino. Basa shiff dapat digunakan sebagai gugus pelindung pada
reaksi O-asilasi.
Gugus
amino kitosan lebih reaktif daripada gugus hidroksilnya, sehingga untuk
menghasilkan O-asilasi kitosan perlu dilakukan proteksi atau
perlindungan terhadap gugus amin selama proses asilasi untuk
menghasilkan O-Asil kitosan. Metode proteksi yang dilakukan antara lain
melalui pembuatan basa Schiff disusul O-Asetilasi menggunakan larutan
asetat anhidrin-piridin untuk mencegah hidrolisis asam dari basa Schiff.
Reaksi antara kitosan dengan anhidrida asetat menghasilkan senyawa
ester yang merupakan kitosan asetat. Dalam hal ini kitosan terlebih
dahulu direaksikan dengan asetaldehida membentuk aldimin untuk
melindungi gugus amina. Kitosan laurat diperoleh dari reaksi
transesterifikasi antara metil laurat dengan kitosan asetat. Selanjutnya
dilakukan deproteksi dengan menambahkan natrium bikarbonat untuk
memperoleh kitosan laurat.
Basa Schiff dapat digunakan sebagai gugus pelindung pada gugus amin (NH2),
dilakukan dengan melarutkan kitosan terasetilasi dalam asam formiat 90%
yang mengandung asetat anhidrida dengan asumsi protonasi akan mencegah
terjadinya N-asilasi. Selanjutnya direaksikan dengan asilklorida dalam
karbon triklorida dan piridin kering.
Contoh lain gugus pelindung untuk NH2 yaitu:
Modifikasi
kimia dari protein tiol dengan reduksi dan alkilasi adalah umum dalam
persiapan sampel proteomik untuk analisis dengan spektrometri massa
(MS). Modifikasi pada kelompok fungsional lainnya kurang mendapat perhatian pada proteomik berbasis-MS.
Modifikasi amina (Lys, N-termini) oleh dimetilasi reduktif atau dengan
asilasi (misalnya pelabelan iTRAQ) baru-baru ini mendapatkan popularitas
dalam pendekatan berbasis peptida (MS dari bawah). Modifikasi pada kelompok asam (Asp, Glu, C-termini) telah dieksplorasi sangat minim.
Di sini, kami menggambarkan strategi pelabelan berurutan yang
memungkinkan modifikasi lengkap tiol, amina, dan asam pada peptida atau
protein utuh kecil. Metode ini termasuk ( 1 ) reduksi dan alkilasi tiol, ( 2 ) reduksi dimetilasi amina, dan ( 3 ) penengahan asam dengan beberapa amina.
Skema modifikasi kimia ini menawarkan beberapa pilihan baik untuk
penggabungan isotop stabil untuk kuantifikasi relatif dan untuk
meningkatkan peptida atau protein sebagai analit MS.
Modifikasi Grup Amino Modifikasi gugus amino melibatkan penambahan gugus fungsi pada ujung N dari asam amino .
Protein setelah terjemahannya mengalami modifikasi kimia yang disebut Post Translational Modification . Modifikasi ini dapat mengubah fungsi protein ketika melekat pada kelompok fungsional biokimia seperti asetat dengan mengubah sifat kimia dari asam amino atau dengan perubahan struktural seperti lipat, distribusi konformasi, stabilitas, aktivitas dll.
Jenis Modifikasi Grup Amino
Asetilasi
Asetalisasi adalah proses asilasi (pengantar gugus asil ke senyawa organik) yang melibatkan substitusi gugus asam asetat organik untuk atom hidrogen aktif pada N-terminus.
Modifikasi paling luas pada eukariota adalah Asetilasi dari kelompok protein α-amina N-terminal. Sekitar 50% protein ragi dan sekitar 90% protein pada manusia dimodifikasi oleh mekanisme ini. Pola modifikasi dilestarikan sepanjang evolusi. Meskipun itu adalah modifikasi umum, tidak banyak informasi yang tersedia untuk tentang fungsi biologis dari asetilasi N-α-terminal. N-α-acetyltransferase (NATs) adalah enzim yang bertanggung jawab untuk Asetilasi. NAT milik keluarga GNAT, yang terletak di bawah superfamili acetyltransferases . [1]
Asetilasi dan deasetilasi terjadi pada residu lisin di ekor N-terminal di asetilasi dan deasetilasi histone . Reaksi-reaksi ini terjadi di hadapan enzim histone acetyltransferase (HAT) atau histone deacetylase (HDAC).
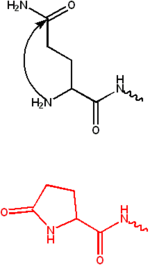
Formasi Pyroglutamate
Pyroglutamate terbentuk melalui siklisasi (pembentukan cincin dalam senyawa kimia) glutamin . Ini biasanya diamati pada antibodi yang mengandung residu glutamat atau glutamin pada N-termini. Gugus amino dan glutamat atau glutamin mengembun membentuk cincin lima anggota yang disebut Pyroglutamate. Residu ini membuat protein lebih tahan terhadap aminopeptidase dan memiliki banyak peran fungsional. [2]
Ia mempertahankan integritas struktural pada N-terminal α-helix dan menyediakan lingkungan yang tepat untuk ionisasi residu Histidin untuk katalisis dan sitotoksisitas terhadap sel HeLa .
Myristoylation
N-myristoylation juga merupakan proses asilasi yang ditemukan khusus untuk gliserin asam amino N-terminal dalam protein di mana kelompok myristoy (berasal dari asam miristat) secara kovalen dilampirkan melalui ikatan amida dengan gugus alpha-amino N-terminal Glycine. Myristoylation memainkan peran penting dalam pensinyalan seluler sekunder, dalam infektivitas retrovirus dan onkogenesis pada Eukariota. Ini juga mempengaruhi fungsi fisiologis protein pengikat kalsium. [3] Enzim cytosolic N-myristoyltransferase (NMT) mengkatalisis Myristoylation.
Methylation
Metilasi protein adalah bentuk modifikasi pasca-translasi yang paling umum yang diamati. Mirip dengan modifikasi pasca-translasi lainnya, metilasi protein terlibat dalam mengatur interaksi protein-protein yang menghasilkan sejumlah besar efek selama peristiwa seluler utama, termasuk pengaturan transkripsi [4] [5] [6] respon stres, penuaan dan perbaikan protein [ 7] Aktivasi sel-T [8] , transportasi nuklir [9] , diferensiasi neuronal [10] , [11] fungsi saluran ion, dan pensinyalan sitokin. Protein dianggap termetilasi ketika kelompok metil ditambahkan pada satu atau lebih rantai samping nukleofilik. Metilasi pada rantai samping nitrogens dianggap sangat tidak dapat diubah sementara metilasi dari gugus karboksil berpotensi reversibel. Residu protein yang termetilasi pada nitrogen termasuk e-amin dari lisin, cincin imidazol histidin, bagian guanidino arginin, dan rantai samping amida nitrit glutamin dan asparagin.
Metilasi dalam protein meniadakan muatan negatif di atasnya dan meningkatkan hidrofobisitas protein. Metilasi pada rantai samping karboksilat menutupi muatan negatif dan menambah hidrofobik. N-Metilasi lisin tidak mengubah muatan kationik tetapi meningkatkan hidrofobik. Khususnya, dimetilasi dan trimetilasi rantai samping lisin dalam protein meningkatkan baik hidrofobik dan massa sterik dan dapat mempengaruhi interaksi protein-protein jika mereka berada dalam permukaan yang berinteraksi.
Karbamilasi
Karbamilasi terjadi ketika asam isocyanic (HCNO) bereaksi dengan residu amino terminus, seperti lisin, dari protein. Ini adalah salah satu modifikasi protein artifactual umum yang diakui untuk fokus Isoeletric . Faktor risikonya adalah urea (chaotrope) yang ada dalam larutan dan berada dalam kesetimbangan dengan amonium sianat . Asam isosianat adalah bentuk sianat yang bereaksi dengan gugus amino protein. Untuk karbamilasi terjadi gugus asam amino protein seperti lisin, rantai samping arginin harus terdeprotonasi yang biasanya terjadi pada pH basa. Karbamilasi terjadi ketika protein dibiarkan pada suhu kamar dalam larutan urea dan di mana asam isosianat dapat dengan bebas bereaksi dengan protein.
Karbamilasi oleh asam isosianat negatif untuk langkah selanjutnya dari karakterisasi protein karena asam isosianat bereaksi dengan ujung amino protein memblokir peptida atau protein ke sekuens N-terminal. Asam isosianat menyerang rantai samping residu lisin dan arginin yang membuat protein tidak cocok untuk banyak pencernaan enzim. Bahkan jika karbamilasi tidak mencegah digest enzimatik, seringkali akan membingungkan hasil dari eksperimen spektroskopi massa dengan peptida yang memiliki waktu retensi dan massa yang tidak terduga. Karbamilasi protein in vivo diamati di beberapa negara berpenyakit. [12]
Formilasi
Formilasi adalah salah satu modifikasi posttranslational protein, di mana protein dimodifikasi oleh lampiran kelompok formil. Mekanisme yang paling umum dipelajari adalah N6-formilasi lisin yang terkait dengan histone dan protein nuklir lainnya. Modifikasi translasi post histone dan protein kromatin lainnya memainkan peran dalam fisiologi ekspresi gen . "Residu N6-formil-lisin muncul untuk mewakili modifikasi sekunder histone endogen, yang mengandung kesamaan kimia dengan lisin N6-asetilasi yang diakui sebagai penentu penting ekspresi gen pada sel mamalia." Dari penelitian itu disimpulkan bahwa modifikasi N6-formil dari lisin mengganggu fungsi sinyal asetilasi dan metilasi, yang memainkan peran dalam fisiologi stres oksidatif dan nitrosatif. [13]
Senyawa amina aromatik primer tidak tersulfonasi merupakan suatu cemaran yang dapat ditemukan di dalam zat warna. Disebabkan toksisitasnya, kadar cemaran ini dibatasi pada tingkat maksimum tertentu, secara khusus ditetapkan sebagai anilina dengan batas maksimum sebesar 100 ppm. Pada kompendial resmi yang dikeluarkan oleh Joint FAO/WHO Expert Committee on Food Additives (JECFA) penentuan senyawa amina aromatik primer tidak tersulfonasi dilakukan melalui reaksi diazotisasi dan kopling diazo dengan menggunakan senyawa garam natrium 2-naftol-3,6 disulfonat sebagai pereaksi pengkopling. Penelitian ini bertujuan untuk mendapatkan metode alternatif pada penentuan kadar amina aromatik primer tidak tersulfonasi dalam tartrazin, sebagai zat warna yang paling banyak digunakan di Indonesia, menggunakan 2-naftol sebagai pereaksi pengkopling. Anilina diekstraksi dari tartrazin dengan menggunakan toluen pada pH 12,3 dan kemudian diekstraksi kembali dari fasa organik dengan menggunakan larutan asam hidroklorida 3 N. Anilina yang terlarut dalam bentuk garam klorida mengalami reaksi dengan asam nitrit, yang diperoleh secara in situ dengan mereaksikan natrium nitrit dan asam hidroklorida, membentuk suatu garam diazonium. Untuk menghilangkan kelebihan asam nitrit dilakukan penambahan urea ke dalam campuran reaksi. Garam diazonium kemudian dikopling dengan 2-naftol pada pH 9,0. Absorbansi larutan diukur pada panjang gelombang 540 nm. Metode ini memberikan kurva kalibrasi linier pada rentang konsentrasi 2-10 ppm dengan persamaan garis regresi Y = 0,0952X – 0,0005 dan r2 = 0,9997. Batas deteksi dan batas kuantisasi metode ini dihitung secara statistik sebesar 0,16 dan 0,54 ppm. Perolehan kembali kadar anilina dalam tartrazin dengan menggunakan metode penambahan baku pada konsentrasi 0,6; 0,8 dan 0,9 ppm adalah 82,7; 86,7 dan 85,6% dengan nilai simpangan baku relatif (RSD) pada semua penetapan kurang dari 5%. Berdasarkan hasil tersebut, dapat disimpulkan bahwa metode ini dapat digunakan sebagai metode alternatif dari metode resmi yang terdapat dalam compendium JECFA untuk penentuan amina aromatik primer tidak tersulfonasi dalam tartrazin.
Pembentukan Kitosan Termodifikasi Proses pembuatan Kitosan termodifikasi
diawali dengan proses
swelling yaitu dengan melarutkan kitosan ke dalam asam asetat hingga
terbentuk gel kitosan. Setelah itu gel yang terbentuk disemprotkan ke dalam
larutan NaOH hingga terbentuk bead kitosan. Proses swelling ini dimaksudkan untuk
meningkatkan luas permukaan dan untuk meningkatkan keporosan kitosan. Setelah proses
swellling, dilakukan proses krosling king kitosan dengan Glutaraldehit. Proses
krosling bead kitosan dengan Glutaraldehit dilakukan dengan mereaksikan bead kitosan
yang telah kering dan dibuat serbuk dengan glutaraldehide. Reaksi yang terjadi
adalah terbentuknya ikatan imine antara gugus amina kitosan dengan aldehide
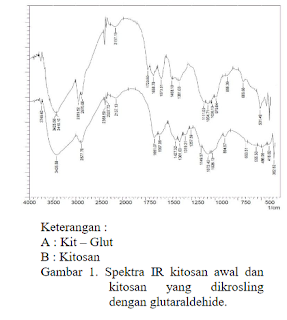
melalui reaksi basa Sciff. merupakan spektra Inframerah dari Kitosan Kitosan Glu
bead.
Sedangkan reaksi yang terjadi pada kitosan yang bercroslingking dengan glutaraldehit
ditunjukkan pada gambar 2.
Hasil spektra inframerah kitosan dan kitosan glutaraldehide (Gambar 1)
menunjukkan bahwa proses krosling berhasil dilakukan. Pada spektra IR kitosan
yang telah dikrosling terlihat meningkatnya puncak pada 2939 cm 1 yang menunjukkan vibrasi ulur CH, yang
dikuatkan dengan semakin tingginya puncak 1381 cm, merupakan vibrasi bending
CH2. Munculnya puncak pada bilangan gelombang 1573 cmadalah vibrasi ulur ikatan
imine (C=N), menunjukkan reaksi antara aldehide dengan amina.
permasalahan
1. Gugus amino kitosan lebih reaktif daripada gugus hidroksilnya, sehingga untuk menghasilkan O-asilasi kitosan perlu dilakukan proteksi atau perlindungan terhadap gugus amin selama proses asilasi untuk menghasilkan O-Asil kitosan. Metode proteksi yang dilakukan antara lain melalui pembuatan basa Schiff disusul O-Asetilasi menggunakan larutan asetat anhidrin-piridin untuk mencegah hidrolisis asam dari basa Schiff.
Nah mengapa metode proteksi yang dilakukan melalui pembuatan basa Schiff disusul O-Asetilasi ? Apakah bisa hanya digunakan satu metode proteksi saja, jika bisa bagaimana hasil yang terjadi pada modifikasi gugus amin tersebut?
2. Modifikasi gugus amino melibatkan penambahan gugus fungsi padaujung N dari asam amino .
Protein setelah terjemahannya mengalami modifikasi kimia yang disebut Post Translational Modification . Modifikasi ini dapat mengubah fungsi protein ketika melekat pada kelompok fungsional biokimia seperti asetat dengan mengubah sifat kimia dari asam amino atau dengan perubahan struktural seperti lipat, distribusi konformasi, stabilitas, aktivitas dll. Nah sebeenarnya apa yang membuat modifikasi gugus amino tersebut merubah fungsi protein? Dan bagaimana mekanisme yang terjadi?
2. Modifikasi gugus amino melibatkan penambahan gugus fungsi padaujung N dari asam amino .
Protein setelah terjemahannya mengalami modifikasi kimia yang disebut Post Translational Modification . Modifikasi ini dapat mengubah fungsi protein ketika melekat pada kelompok fungsional biokimia seperti asetat dengan mengubah sifat kimia dari asam amino atau dengan perubahan struktural seperti lipat, distribusi konformasi, stabilitas, aktivitas dll. Nah sebeenarnya apa yang membuat modifikasi gugus amino tersebut merubah fungsi protein? Dan bagaimana mekanisme yang terjadi?
3.
- RNH 2 + R′C (O) R ′ ′ → RN = C (R ′) (R ′ ′) + H 2 O
4. imina mengacu pada analog aza dari epoksida.Dengan demikian, etilenimin adalah spesies cincin beranggota tiga C2H4 NH. Imina terkait dengan keton dan aldehid dengan penggantian oksigen dengan kelompok NR. Ketika R = H, senyawa tersebut adalah imina primer, ketika R adalah hidrokarbil , senyawa tersebut adalah imina sekunder.Imina menunjukkan reaktivitas yang beragam dan biasanya ditemui di seluruh kimia. Bagaimana tahap pergantian oksigen pada imina yang terkait dengan keton dan aldehid tersebut?