Sebagian besar molekul organim memiliki ikatan σ C–C and C–H. Ikatan ini bersifat kuat, nonpolar, dan tidak mudah terputus. Molekul-molekul organik memiliki ciri khas berupa sifat struktural sebagai berikut:
Sifat struktural inilah yang membedakan suatu molekul organik dengan molekul lainnya. Sifat ini menentukan geometri, sifat fisik dan reaktivitas suatu molekul, dan termasuk dalam apa yang disebut sebagai gugus fungsional.
Dalam kimia organik, setiap atom selain karbon atau hidrogen dalam molekul organik disebut heteroatom, dimana hetero-berarti "berbeda baik dari karbon atau hidrogen."
Struktur hidrokarbon dapat berfungsi sebagai kerangka dipasangnya heteroatom. Sama seperti ornamen yang memberikan karakter ke pohon natal, jadi jangan heteroatom memberikan karakter pada molekul organik. Dengan kata lain, heteroatom dapat memiliki efek mendalam pada sifat-sifat suatu molekul organik.
Molekul organik diklasifikasikan menurut kelompok kandungan fungsional mereka, sebuah kelompok fungsional didefinisikan sebagai kombinasi atom yang berperilaku sebagai sebuah unit. Sebagian besar kelompok fungsional dibedakan oleh kandungan heteroatom mereka.
Heteroatom berperan dalam menentukan sifat kelas masing-masing yang merupakan tema dasar. Ketika Anda mempelajari materi ini, fokus pada pemahaman kimia dan sifat fisik ofcompounds berbagai kelas, untuk melakukan hal itu akan memberikan penghargaan yang lebih besar dari keragaman yang luar biasa dari molekul organik dan banyak aplikasi mereka
- Heteroatom–atom selain karbon atau hidrogen. Heteroatom pada umumnya adalah nitrogen, oksigen, sulfur, fosfor dan halogen.
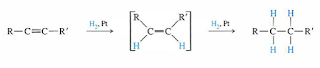
- Ikatan π. Sebagian besari ikatan π terdapat pada ikatan rangkap dua C–C dan C–O.
Etanol memiliki pasangan elektron bebas dan ikatan polar yang membuatnya bersifat reaktif dengan berbagai macam pereaksi.
Penggolongan Gugus Fungsi
Secara umum gugus fungsional atau selanjutnya disebut gugus fungsi dapat dibedakan menjadi tiga jenis, yaitu:
Hidrokarbon
Hidrokarbon merupakan senyawa yang hanya terdiri dari unsur karbon dan hidrogen. Ikatannya dapat bersifat alifatik maupun aromatik.
- Hidrokarbon alifatik. Hidrokarbon alifatik dapat digolongkan menjadi 3:
- Hidrokarbon aromatik. Kelompok ini dinamakan demikian karena saat pertama diketahi senyawa ini memiliki karakteristik aroma yang kuat.
Hidrokarbon aromatik yang paling sederhana adalah benzen. Cincin anggota-enam dan tiga ikatan π pada benzen membentuk gugus fungsitunggal. Benzen adalah komponen dari campuran BTX (B untuk benzen) yang ditambahkan ke gasolin untuk meningkatan nilai oktan.
Ketika cincin benzen diikatkan pada gugus lain, maka disebut gugus fenil. Misalnya pada fenilsiklohekana, suatu gugus fenil terikat pada cincin sikloheksana.
Tabel di bawah ini merangkum keempat jenis hidrokarbon.
Jenis senyawa
|
Struktur umum
|
Contoh
|
Gugus fungsi
|
Alkana
|
–
| ||
Alkena
|
Rangkap dua
| ||
Alkuna
|
Rangkap tiga
| ||
Senyawa aromatik
|
Gugus fenil
|
Karena alkana tidak memiliki gugus fungsi, maka sifatnya tidak reaktif kecuali di bawah kondisi yang sangat drastis. Misalnya, polietilen, suatu plastik sintetik yang merupakan alkana dengan berat molekul tinggi yang terdiri dari rantai –CH2– yang terikat satu sama lain, sepanjang ratusan hingga ribuan atom. Karena merupakan alkana yang tidak memiliki sis reaktif, maka senyawa ini sangat stabil dan tidak mudah terdegradasi, namun akibatnya mampu bertahan selama bertahun-tahun di tempat pembuangan sampah.
Senyawa yang memiliki ikatanσ C–Z
Keberadaan heteroatom Z yang bersifat elektronegatif menciptakan suatu ikatan polar, memboat karbon mengalami defisiensi (kekurangan) elektron. Pasangan elektron bebas pada Z dapat bereaksi dengan proton dan elektrofil lainnya, khususnya jika Z = N atau O. berbagai senyawa sederhana dalam kategori ini telah banyak dimanfaatkan. Misalnya, kloroetana (CH3CH2Cl, umumnya disebut etil klorida) merupakan suatu alkil halida yang digunakan sebagai anestesi lokal. Kloroetana menguap dengan cepat ketika disemprotkan pada luka, menyebabkan raa dingin yang menyebabkan rasa kebas pada bagian terjadinya cedera.
Molekul-molekul yang mengandung gugus fungsi ini ada yang sederhana, namun ada pula yang sangat kompleks. Dietil eter, anestesi umum pertama yang merupakan eter sederhana dikarenakan mengandung atom O tunggal yang terikat pada dua atom C. Sedangkan hemibrevetoksin B, megnandung empat gugus eter, disamping gugus fungsi lainnya.
<dietil eter> <hemibrevetoksin B>
Senyawa yang memiliki gugus C=O
Ada banyak jenis gugus fungsi yang mengandung ikatan rangkap dua C–O (gugus karbonil). Ikatan polar C–O membuat karbon karbonil bersifat elektrofil, sedangkan pasangan elektron bebas pada O menjadikannya nukleofil dan basa. Gugus karbonil juga mengandung satu ikatan π yang lebih mudah putus dibandingkan ikatan σ C–O. Atenolol dan donepezil merupakan contoh obat yang mengandung berbagai gugus fungsi. Atenolol merupakan suatu β-bloker, suatu kelompok obat yang digunakan untuk menangani hipertensi. Sedangkan donepezil, digunakan untuk menangani demensia yang berkaitan dengan penyakit Alzheimer.
Peran dari suatu gugus fungsi tidak dapat ditentukan. Suatu gugus fungsi menentukan sifat-sifat molekul berikut:
- pada suatu alkohol manipulasi gugus fungsi sangat diperlukan, yaitu bagaimana alkil yang berupa CH3 dapat disumbangkan.
-
- Hal ini dapat dilakukan dengan cara yaitu merubah alkohol menjadi sulfonat ester, dengan menggunakan katalis yang basa piridin.
-
- Basa piridin digunakan sebgai katalis, dimana PEB dari nitrogen (N) akan mengikat PEB dari atom hidrogen (H).
-
- Nitrogen akan mengikat Hidrogen, tetapi ikatan ini hanya sementara saja karena Hidrogen belum putus, karena pada toksilat ada Cl yang lebih reaktif untuk mengikat Hidrogen maka ikatan N dan H lepas sehingga piridin terbentuk kembai (katalis terbentuk kembali) sehingga Hidrogen putus dan menyebabkan oksigen bermuatan negatif (-) dan dan S bermuatan positif (+). selanjutnya O negatif akan berikatan dengan S positif, karena ikatan pada fenol terjadi resonansi sehingga ikatan akan cenderung mengarah ke fenol sehingga atom O yang terikat pada S dapat putus sehingga terbentuk sulfonat ester dan terbentuk CKarbokation metil sebagai agen pengalkilasi.
-
- kasus selanjutnya yaitu, bagaimana R tersier pada gambar diatas dapat menjadi agen alkilasi dan bagaimana bisa terbentuk senyawa sianida.
adapun cara-caranya adalah sebagai berikut:
- penyumbang Cn berasal dari Trimetil Silil Klorida (Me3SiCn)
- mengguakan katalis SnCl4, yang merupakan asam lewis karena Sn sebagai logam transisi memiliki orbital d yang kosong dimana orbital tersebut terisis oleh elektron dari Cl.
Permasalahan :
1. Mengapa suatu heteroatom memiliki dapat menentukan kan sifat kelas masing2 pada molekul organik?
2. Bagaimana suatu reaktifitas dari heteroatom terhadap suatu molekul organik?
3. Peran dari suatu gugus fungsi tidak dapat ditentukan,tetapi Suatu gugus fungsi menentukan sifat-sifat molekul yaitu Ikatan dan bentuk,Jenis dan kekuatan gaya antarmolekul,Sifat fisik,Tatanama,Reaktivitas kimiawi. Nah bagaimana tanggapan anda tentang pertanyaan tersebut dan bagaimana gugus fungsi menentukan sifat -sifat molekul itu tadi?
3. Peran dari suatu gugus fungsi tidak dapat ditentukan,tetapi Suatu gugus fungsi menentukan sifat-sifat molekul yaitu Ikatan dan bentuk,Jenis dan kekuatan gaya antarmolekul,Sifat fisik,Tatanama,Reaktivitas kimiawi. Nah bagaimana tanggapan anda tentang pertanyaan tersebut dan bagaimana gugus fungsi menentukan sifat -sifat molekul itu tadi?